Cette déclaration a été faite lorsque les développeurs de PicoQuant en Allemagne ont demandé au professeur ses commentaires sur leur dernier prototype d’un nouveau microscope de fluorescence à comptage de photons unique. Depuis, le prototype est devenu un produit complet nommé Luminosa.
Au cours des dernières décennies, les développeurs de PicoQuant se sont concentrés sur la fabrication des microscopes à fluorescence résolu en temps les plus sensibles et reproductibles. Ils ont désormais franchi l’étape suivante et créé un système plus facile à utiliser sans aucun compromis sur la sensibilité. Le résultat est une véritable percée puisqu’il rend ces systèmes accessibles aux utilisateurs qui ne bénéficient pas du soutien d’un physicien confirmé. Le nouveau Luminosa permet désormais à chaque chercheur en biophysique moléculaire ou en biologie structurale d’intégrer facilement les méthodes de la microscopie à fluorescence à molécule unique et à résolution temporelle dans leur boîte à outils.
Ces méthodes incluent :
L’imagerie de temps de vie de fluorescence - FLIM
La FLIM est une technique d’imagerie par fluorescence qui résout et affiche la durée de vie des fluorophores individuels plutôt que leur spectre d’émission. La durée de vie de fluorescence est définie comme le temps moyen pendant lequel une molécule reste dans un état excité avant de revenir à l’état stable en émettant un photon. Comme la durée de vie de fluorescence n’est pas liée à la concentration, à l’absorption par l’échantillon, à l’épaisseur de l’échantillon, au photoblanchiment et/ou à l’intensité de l’excitation, la FLIM est moins sujette aux artefacts que les méthodes fondées sur l’intensité.
Avantages de FLIM :
- Peut-être utilisée pour distinguer les fluorophores
- Fournit une dimension supplémentaire de l’information
- Complémentaire à l’information spectrale
- Technique de choix pour de nombreux types d’imagerie fonctionnelle, car la durée de vie d’un fluorophore peut être influencée par des paramètres environnementaux tels que le pH, la concentration d’ions ou d’oxygène, ou la liaison moléculaire
Le transfert d’énergie par résonance basé sur le temps de vie - FLIM-FRET
Le FRET est un processus non radiatif par lequel l’énergie d’une molécule fluorescente excitée (donneur) est transférée à un fluorophore (accepteur) non exposé à proximité dans la gamme de 2-10 nm. Le transfert d’énergie entraîne l’extinction du donneur et entraîne des changements dans l’intensité de fluorescence des deux fluorophores et un raccourcissement de la durée de vie du donneur seulement.
Contrairement à la FRET standard où l’on mesure les changements d’intensité de fluorescence, la FRET basée sur le temps de vie permet une analyse quantitative en utilisant la durée de vie de fluorescence de la molécule donneuse comme sonde, qui est indépendante de la concentration sur une large gamme. Ceci est crucial car dans les systèmes biologiques comme les cellules, la concentration de fluorophore ne peut souvent pas être déterminée avec précision et comparée entre les différentes cellules.
Avantages de FLIM-FRET :
La FRET basée sur la durée de vie peut identifier différentes sous-populations ayant des efficacités FRET différentes, là où la FRET basée sur l’intensité ne détecterait que la valeur moyenne.
Le transfert d’énergie par résonance de molécule unique - smFRET
Dans ce type d’expériences, le processus FRET est observé au sein d’une molécule unique (portant un donneur et un accepteur), ou entre des partenaires en interaction qui sont soit en diffusion libre au travers du volume confocal soit immobilisé sur une surface.
L’excitation pulsée entrelacée (Pulse Interleaved Excitation - PIE) est une technique qui peut être très utile pour faire du smFRET, c’est une technique d’excitation dans laquelle plusieurs lasers pulsés sont synchronisés. Les impulsions laser sont séparées sur une échelle de temps nanoseconde pour permettre l’enregistrement simultané du comportement temporel d’une molécule d’échantillon.
Dans une expérience smFRET, cela permet d’exciter le donneur et l’accepteur alternativement. De cette façon, le colorant accepteur est excité indépendamment du processus FRET pour confirmer sa présence et sa photoactivité. Les molécules dépourvues d’un donneur actif ou d’un accepteur sont séparées des complexes FRET actifs. Ceci permet de différencier une molécule FRET, même avec une efficacité de FRET très faible, d’une molécule avec un accepteur absent ou non fluorescent.
Découvrez des expériences simplifiées de smFRET dans cet article paru dans PhotonicsViews
La spectroscopie de corrélation de fluorescence - FCS
La spectroscopie de corrélation de fluorescence (FCS) est une analyse de la corrélation des fluctuations temporelles de l’intensité de fluorescence. Elle offre des aperçus sur la photo-physique qui causent ces fluctuations caractéristiques ainsi que sur le comportement de diffusion et les concentrations absolues des particules détectées. La FCS permet de déterminer des paramètres biochimiques importants tels que la concentration et la taille ou la forme de la particule (molécule) ou la viscosité de leur environnement.
Et également la spectroscopie de corrélation de temps de vie de fluorescence (FLCS) et la spectroscopie croisée de corrélation de fluorescence (FCCS).
L’imagerie d’anisotropie
La mesure de l’anisotropie de fluorescence à l’état stationnaire et particulièrement résolue en temps offre des possibilités fascinantes d’étudier l’orientation moléculaire et la mobilité ainsi que les processus qui les affectent. En général, l’anisotropie ne dépend pas de la concentration des fluorophores, elle est par exemple indépendante de l’intensité du signal détecté. Ceci est particulièrement important pour l’interprétation des mesures smFRET lorsque la mobilité du fluorophore peut affecter l’efficacité du transfert par résonance. Les mesures d’anisotropie résolue en temps sont plus instructives, car les mesures à l’état stationnaire ne donnent que les valeurs moyennes dans le temps, sans un aperçu direct de la dynamique du processus.
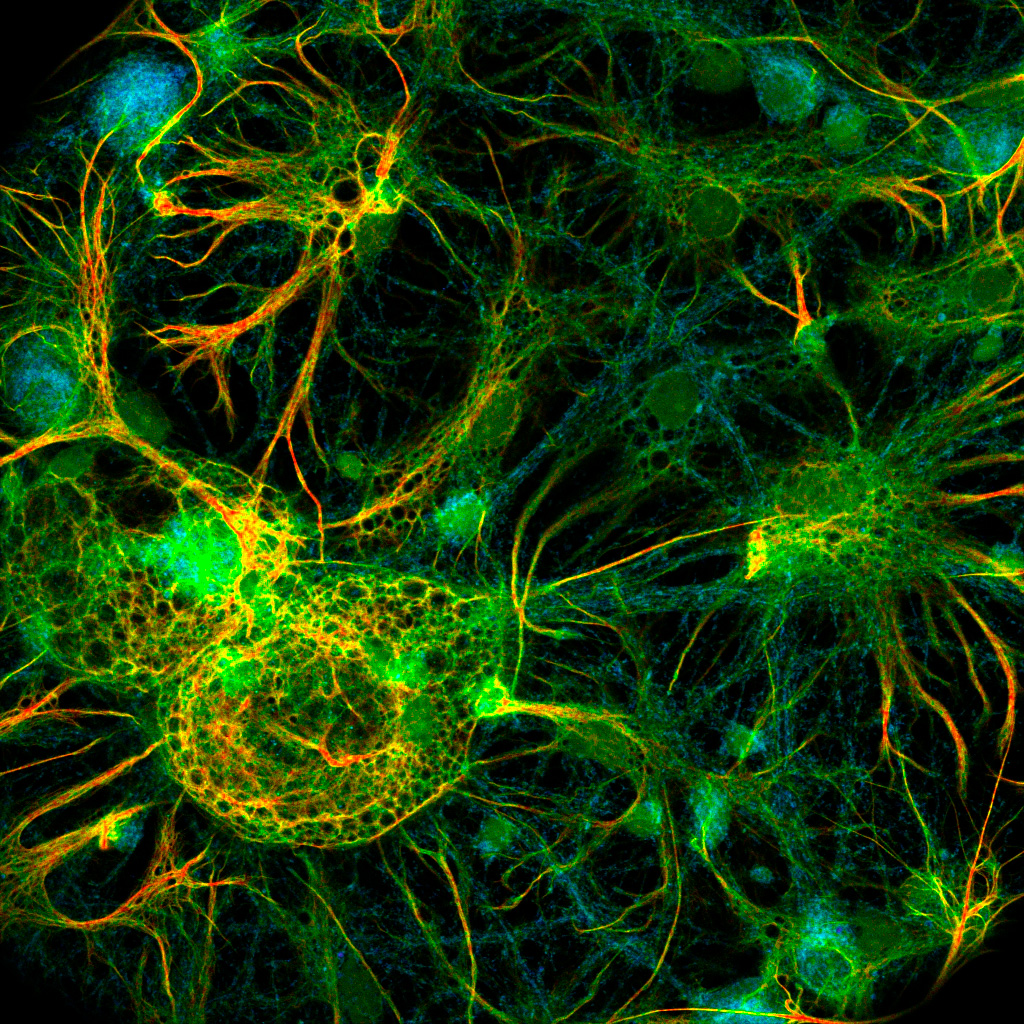
Confocal fluorescence lifetime image of fixed and stained neurons. 3 labels were recorded in a single detection channel. The average fluorescence lifetime per pixel calculated on the fly immediately reveals different features.
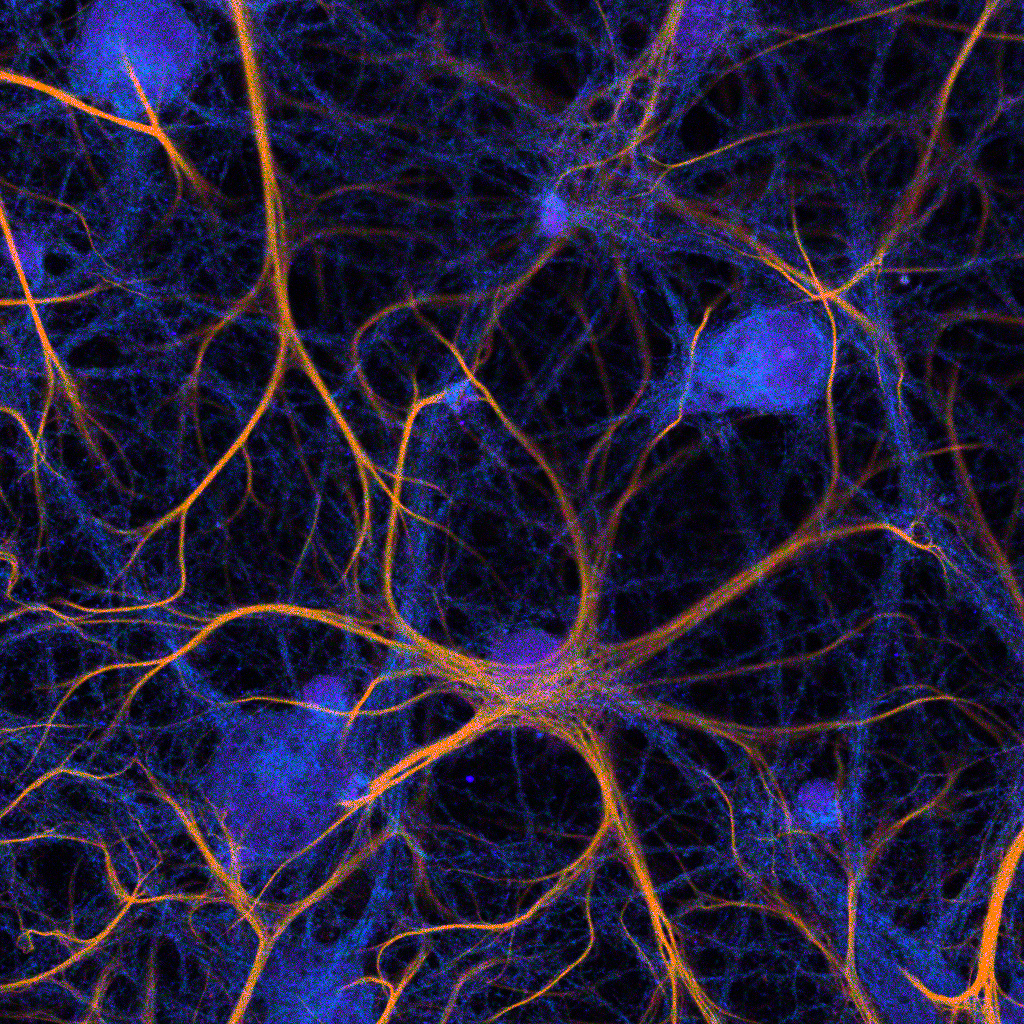
Confocal fluorescence lifetime image of fixed and stained neurons. 3 labels emitting in a single detection channel were discriminated by fluorescence lifetime fitting, and fit results are overlaid.
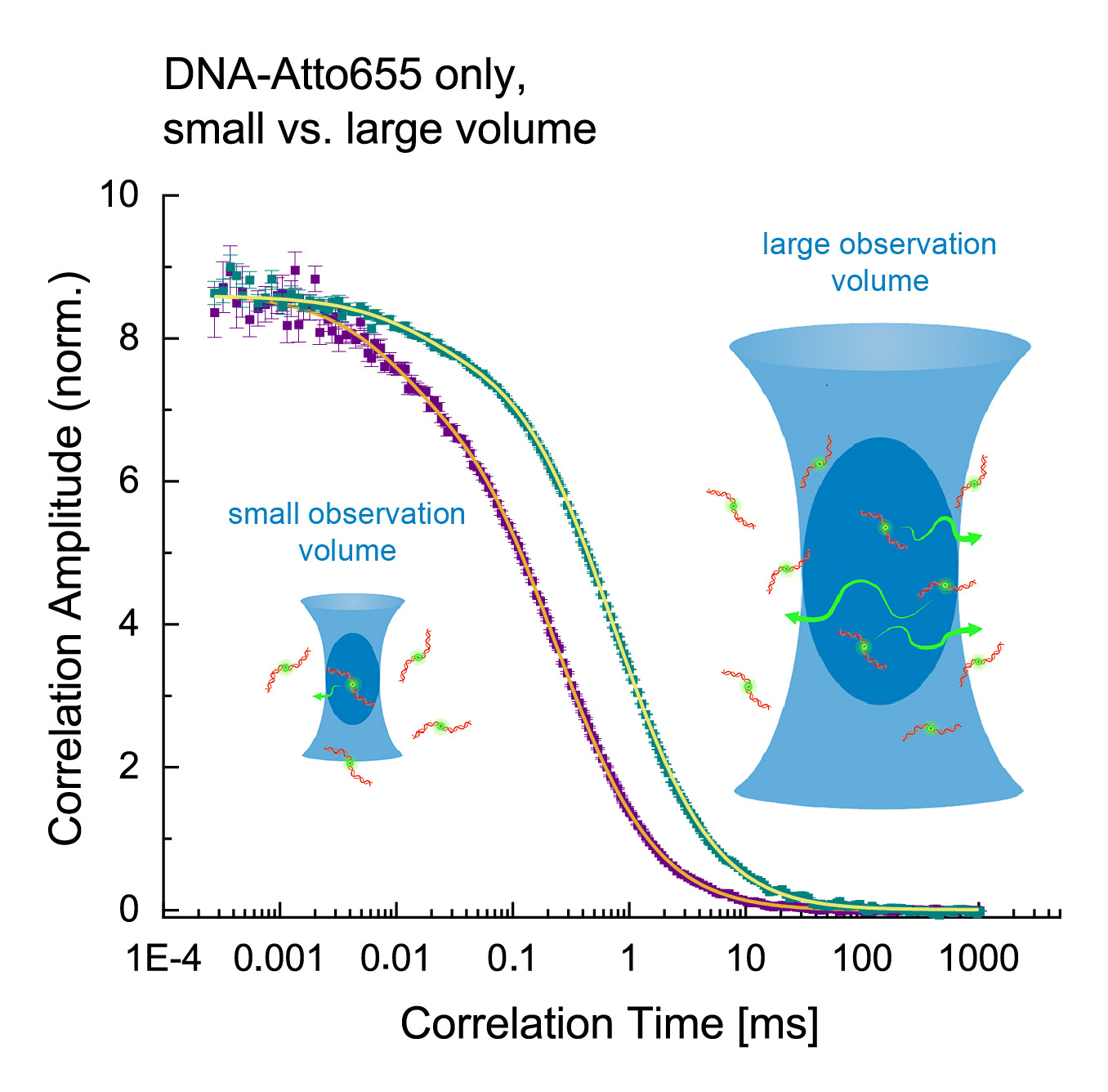
FCS curves of freely diffusing DNA labeled with Atto655, recorded with Luminosa in a small and a large observation volume. The difference of observation times in both volumes clearly shifts the FCS curve. (Image created with Biorender.com)