Article parut dans la revue "Annales des falsifications, de l'expertise chimique et toxicologique n°982/1er semestre 2015" de la Société des Experts Chimistes de France. Le contenu de cet article a fait l’objet d’une présentation orale de Enrique Lozano Diz lors de la Matinale SECF sur les Matières Premières à Usage Pharmaceutiques, qui s’est tenue à Paris, Maison de la chimie, le 14 Novembre 2014.
Enrique Lozano Diz1, Grégoire Saget2,
1 BWTek 19 Shea Way, Suite 301, Newark, DE 19713, USA : enriquel@bwtek.com
2 Opton Laser International, 29, rue Jean Rostand, 91893 Orsay Cedex : gregoire.saget@optonlaser.com
1. Introduction
La spectroscopie Raman a été découverte et développée dans la première moitié du XXème siècle par Sir C.V. Raman, prix Nobel de Physique 1930 pour la découverte de l’effet éponyme. Il s’agit d’une technique de spectroscopie basée sur l’observation de la diffusion inélastique de la lumière lorsqu’un faisceau monochromatique interagit avec la matière. Elle donne notamment accès à des informations relatives aux modes vibrationnels et rotationnels de la matière, caractérisant ainsi sa nature chimique et ses propriétés physiques. Cet article présentera un bref parcours des avancées de la technique et de la technologie qui y est associée, pour finir avec un état des lieux de la situation actuelle et un exemple d’utilisation d’un système compact dédié aux matières premières à usage pharmaceutique : le NanoRam®.
2. Le développement historique de la spectroscopie Raman
La spectroscopie Raman est basée sur une propriété de la lumière (la diffusion inélastique) quand elle interagit avec la matière. Pendant cette interaction, le photon est absorbé puis diffusé avec une énergie différente (gain ou perte) à cause des transitions à travers les modes vibrationnels fondamentaux de la matière. Expliquée d’une manière simple, la spectroscopie Raman permet d’avoir une empreinte ou une signature physico-chimique de la matière irradiée dans des conditions données. Quand le principe est découvert en 1928 (d’abord par Chandrashekhara Venkata Râman dit Sir Raman Sir et presque similtanément par Leonid Issaakovitch Mandelstam [1]), il génère une vague de recherches inédites en spectroscopie. Les chercheurs voient s’ouvrir de nouvelles potentialités: obtenir des informations directes sur la composition chimique et les caractéristiques physiques de la matière. De plus, la spectroscopie Raman avait un avantage significatif sur d’autres techniques alors en cours de développement; il n’y a pas de contact direct avec la matière car il s’agit d’une mesure optique qui limite les contaminations ou les risques de destruction. A la fin des années 1930, elle est la technique par excellence pour les analyses non destructives. La spectroscopie Raman répond en effet à un rêve caressé depuis longtemps par la communauté scientifique : celui d’obtenir des informations qualitatives et quantitatives sur la nature de la matière- de manière non destructive,
- sans contact,
- sans préparation
- sans changement d’état (solide, gaz, gel, poudre…),
- et en mettant en évidence ses propriétés physico-chimiques.
Néanmoins, cette technique pose un certain nombre de problèmes pratiques. Seul un photon sur un million ou un milliard subit une diffusion inélastique et intervient donc donc un signal Raman. En conséquence, il faut une source monochromatique et puissante (pour générer beaucoup de photons) et un système de détection de très haute résolution (pour distinguer les molécules) et ultra-sensible pour détecter les quelques de photons émis. Tout cela implique l’utilisation de systèmes optiques complexes et des professionnels hautement qualifiés ; cela rend la technique peu efficace, très lourde et inaccessible pour la plupart des chercheurs.
Le développement de la spectroscopie infrarouge à la fin des années 1930 est, en partie, motivé et facilité par les progrès de la spectroscopie Raman. Les techniques comportent des similitudes. Elles s’intéressent toute deux aux signatures vibrationnelles moléculaires en observant les liaisons covalentes. Cependant, l’infrarouge observe des variations de moment diélectrique, tandis que le Raman observe les variations de moment dipolaire. En conséquence, les règles de sélection des excitations « vues » par Raman et Infrarouge sont légèrement différentes et donnent une complémentarité aux données ainsi obtenues [2]. La spectroscopie infrarouge dispersive n’est pas, a priori, une technique supérieure à la spectroscopie Raman. Elle comporte notamment certaines contraintes importantes, comme sa sensibilité à la présence d’eau, l’influence de l’atmosphère locale, etc…Mais son déploiement a été beaucoup plus rapide, et ce principalement pour des raisons pratiques. Les instruments infrarouges sont plus accessibles et très simples à utiliser pour la communauté académique et ses chercheurs. En conséquence, la technique Raman est restée peu utilisée durant quelques années et circonscrite uniquement à un nombre limité de laboratoires de recherche.
Dans les années 60, la découverte et la commercialisation des premiers lasers [3] offrent la possibilité d’une nouvelle croissance à la spectroscopie Raman. Voilà enfin la source de lumière idéale nécessaire pour la spectroscopie Raman : un faisceau de lumière monochromatique et de haute énergie. Mais, malgré cette avancée fondamentale, le nombre de laboratoires utilisant cette technique restera encore très limité car trop complexe pour être utilisée par des chercheurs non spécialisés. En cette même période, le développement de la spectroscopie infrarouge est aussi favorisé par la découverte du laser qui accroit la stabilité et la précision des interféromètres de Michelson. De plus, on voit apparaître les premiers systèmes infrarouges à transformée de Fourrier (IRTF) plus précis, plus rapides et de plus haute résolution que la technologie Raman de l’époque.
Dans les années 80, le développement de la spectroscopie infrarouge donne un coup de vigueur à sa technique sœur, la spectrométrie Raman. Elles vont jusqu'à fusionner avec le développement du Raman à transformée de Fourier (Raman-TF) [4] qui préfigure la vraie renaissance de la spectrométrie Raman. Enfin, et grâce aux énormes progrès de la spectroscopie infrarouge, la spectroscopie Raman peut être utilisée comme technique analytique de routine. De nombreux laboratoires commencent à l’utiliser pour des analyses où la spectroscopie infrarouge ne pouvait l’être :
- analyse de polymorphes,
- analyse de la structure microcristalline locale,
- analyse des systèmes aqueux, etc.
C’est aussi à cette époque qu’un développement technique introduit indirectement un nouvel atout pour le déploiement de la spectroscopie Raman. Dans les années 80, l’astronomie pousse au développement de nouveaux instruments ayant quelques similitudes avec les besoins de la spectroscopie Raman. Comme dans le cas de la dispersion Raman, il s’agit de capter de très faibles quantités de photons (émis par les étoiles) à des longueurs d’onde particulières bien précises, ce qui requiert des spectromètres de très haute résolution, et éviter l’éblouissement du détecteur par des sources de lumières proches du point de l’analyse (filtrer la lumière d’étoiles à proximité de celle(s) étudiée(s) ou, dans le cas du Raman, éviter d’enregistrer la lumière du faisceau laser). C’est ainsi que des dispositifs à transfert de charges (détecteurs CCD1) et de puissants nouveaux filtres Rayleigh sont mis à disposition du grand public.
A la fin des années 80 et au début des années 90, la communauté scientifique dispose enfin d’un grand nombre d’instruments Raman et la technique reprend un élan important et devient routinière dans certains laboratoires universitaires. Cependant le nombre de laboratoires industriels équipés reste très faible, sauf dans le secteur pharmaceutique qui en fait une large utilisation pour la caractérisation de nouveaux composés et pour identifier les polymorphes.
Les instruments de cette époque sont encore assez volumineux et sensibles aux conditions extérieures. Bien que les systèmes optiques « empruntés » à la spectroscopie infrarouge ou à l’astronomie ne soient pas conçus pour la technique elle-même, ils donnent cependant de bons résultats. La majorité des unités sont des instruments connectés à des microscopes car ils apportent une résolution spatiale nettement supérieure (x10) et en trois dimensions. C’est ainsi que pendant quelques années, toute une génération d’étudiants et de futurs chercheurs ont associé la technique Raman avec la microscopie. On notera aussi que ce type d’équipement est encore commercialisé de nos jours.
Toujours à cette période, la technologie Raman connait une croissance impressionnante dans le développement de nouvelles méthodologies d’analyse, telles que la diffusion Raman exaltée de surface ou effet SERS2. C’est une technique qui utilise des métaux nanostructurés pour la détection d’une molécule et qui produit une augmentation significative du signal Raman des molécules adsorbées sur ces surfaces métalliques rugueuses. Les résultats peuvent être spectaculaires et permettent dans certains cas la détection de quantités infimes de matière, de l’ordre de la ppb [5]. La « spectroscopie par diffusion Raman cohérente anti-Stockes (CARS3 ), qui est une technique multi-laser permettant d’avoir un signal cohérent et plus intense, intéressant pour l’imagerie, constitue un autre exemple. On citera aussi le SRS -Stokes Raman Spectroscopy- [6], le RR -Raman Résonant-, l’ARRS -Angle-Resolved Raman Spectroscopy-, le TR -Transmission Raman-, etc.
Finalement, c’est au début du XXIeme siècle que la spectroscopie Raman commence à toucher un large public. Les appareils deviennent compacts, puis portables, suscitant ainsi un énorme intérêt dans de nombreux domaines. Il y a désormais très peu de problèmes techniques qui arrêtent la spectroscopie Raman.
Les premiers systèmes Raman portables commerciaux se sont adressés à deux marchés bien spécifiques :
- le militaire avec le TacticID®, pour la détection rapide sur champ d’agents chimiques, drogues et explosifs
- le médical, avec les sociétés BWTek et Pharmanex (pour l’analyse des antioxydants)
Au cours des cinq dernières années, le monde de l’instrumentation analytique a été fortement bouleversé avec l’apparition d’une toute nouvelle génération d’équipements Raman portables avec des capacités tout à fait remarquables et inenvisageables seulement 20 années plus tôt. Voilà les instruments Raman devenus légers – les nouvelles unités pèsent en moyenne moins d’un kilogramme -, et capables de faire des analyses complexes ; par exemple, le système BWTek TacticID® permet des analyses de mélanges chimiques contenant jusqu’à une dizaine de composés/molécules. Ces systèmes peuvent être utilisés par toute sorte d’utilisateurs : par des scientifiques –recherche sur le terrain-, par des policiers ou pompiers pour l’identification de matières illégales ou dangereuses, par des employés d’entrepôts des usines chimiques ou pharmaceutiques pour le contrôle des approvisionnements, etc. De plus, le développement rapide des nanotechnologies facilite la mise en place de la technologie SERS, ouvrant ainsi la porte à la détection, directement sur le terrain, d’ultratraces, de contaminants, etc.
Parallèlement au développement du système optique, l’analyse et le traitement des données ont beaucoup progressé. La chimiométrie permet l’extraction d’informations cachées dans la masse de signaux que contient un spectre Raman. Cela ouvre la voie à de nouveaux champs d’application comme la détection de l’adultération du lait par introduction de faibles taux d’urée, à des niveaux de l’ordre de la partie par million (ppm) [7].
3. Exemples d’utilisation sur le terrain d’un équipement portable Raman miniature dans le domaine pharmaceutique
La mise en circulation de médicaments de faible qualité est un problème grave de santé publique et leur détection un enjeu majeur. Selon l'Organisation Mondiale de la Santé (OMS), 1 médicament sur 3 serait contrefait dans les pays africains et 1 sur 5 dans les anciennes républiques soviétiques. Le marché de la contrefaçon, estimé à plus de 75 milliards de dollars par an, ne représente de plus qu’une partie du marché des médicaments dits « de pauvre ou de faible qualité. Ce sont des médicaments qui sont tout à fait authentiques, mais qui ne devraient pas être commercialisés pour des raisons diverses telles que la dégradation du principe actif (dépassement de la date de péremption, effets de la température, de la lumière, de l’humidité, etc.) ou des défauts dans la procédure de fabrication.
Les problèmes associés à ces médicaments contrefaits ou de faible qualité peuvent être multiples: absence totale ou partielle du principe actif, excès de principe actif, incompatibilité chimique entre les principes actifs et les excipients, toxicité des produits de décomposition du médicament, etc…La spectroscopie Raman, permet l’identification de la plupart de ces produits défectueux ou contrefaits, d’une manière rapide et simple. En plus, cette identification peut se faire directement sur le terrain avec les appareils portables et miniatures récents.
Nous rapportons ci-dessous (Tableau1) des résultats obtenus sur des comprimés avec l’unité Raman portable Nanoram® (laser de 785 nm et détecteur type CCD stabilisé thermiquement).
Afin de générer une méthode pour chaque matière, une vingtaine de spectres de chaque produit a été enregistrée, chaque méthode comprenant 10 comprimés.
Pour évaluer un échantillon en fonction d’une méthode, on lui attribue une valeur de probabilité (p-valeur). Si cette valeur est supérieure ou égale à 0,05, le principe actif est identifié (réponse : PASS). Si la p-value est inférieur à 0,05, la matière est refusée (réponse : FAIL). Un produit refusé est un produit qui dévie trop des comprimés ayant servi à développer la méthode.
|
Code Produit |
Produit |
Principe actif |
Dose (mg) |
Source |
Liste des excipients |
p-valeur |
|
R1 |
Aspirin |
Acide acetylsalicylique |
75 |
UK |
MCC, amidon de maïs, silice colloidale anhydre, acide stéarique |
0,9744 |
|
R3 |
Plavix |
Hydrogénosulphate de clopidogrel |
75 |
UK |
Mannitol, macrogol 6000, MCC, huile de ricin hydrogénée, HPC faiblement substituée, hypromellose, monohydrate de lactose, triacétine, dioxyde de titane, rouge d’oxyde de fer, cire de carnauba |
0,1142 |
|
R6 |
Inderal |
Hydrochlorure de Propranolol |
160 |
UK |
Erythrosine, éthyl cellulose, gélatine, glycerol, rouge d’oxyde de fer, noir d’oxyde de fer, methylhydroxypropylcellulose, MCC, dioxyde de titane |
0,8659 |
|
T1 |
Juspirin |
Acide acetylsalicylique |
81 |
Arabie Saoud. |
Non Enregistré |
0,1253 |
|
T3B3 |
Clopidogrel |
Hydrogénosulphate de clopidogrel |
75 |
Liban |
Macrogol 6000, MCC, HPC, dibéhenate de glycérol, huile de ricin hydrogenatéel, opadry II rose (contenant: rouge d’oxyde de fer, macrogol 4000, PVC, dioxyde de titane et talc) |
0,0032 |
|
T3B2 |
Plavix |
Hydrogénosulphate de clopidogrel |
75 |
Egypte |
Mannitol, macrogol 6000, MCC, huile de ricin hydrogénée, HPC faiblement substituée, hypromellose, Monohydrate de lactose, triacétine, dioxide de titane,rouge d’oxyde de fer, cire de carnauba |
0,0000 |
|
T3B1 |
Plavix |
Hydrogénosulphate de clopidogrel |
75 |
Turquie |
Mannitol, macrogol 6000, MCC, huile de ricin hydrogénée, HPC faiblement substituée, hypromellose, monohydrate de lactose, triacétine, dioxide de titane, rouge d’oxyde de fer, cire de carnauba |
0,2122 |
|
T6B1 |
Propranolol |
Propranolol |
10 |
Liba, |
Non Enregistré |
0,1475 |
|
T6B2 |
Indicarin |
Propranolol |
10 |
Arabie Saoud. |
Non Enregistré |
0,0000 |
|
T6B3 |
Apo-propranolol |
Propranolol |
10 |
Liban |
Farine de maïs, laque aluminique de jaune D&C No 10, jaune FD&C No.6, monohydrate de lactose, stéarate de magnesium et cellulose microcristalline |
0,0000 |
Tableau 1. Les échantillons de référence sont notés avec un R dans le code produit et les échantillons de travail avec un T.
Une réponse FAIL correspond soit à un produit de mauvaise qualité, soit à un produit contrefait. Pour les différencier, un deuxième algorithme prend le relai pour essayer de trouver une similitude avec une molécule de la base de données. S’il s’agit de la même molécule, c’est un produit de mauvaise qualité, s’il s’agit d’une autre molécule, c’est une contrefaçon.
L’activité Raman d’un composant est proportionnelle à sa concentration mais elle est aussi influencée par son environnement, c'est-à-dire que la présence des excipients peut changer partiellement sa signature ainsi que la visibilité de la signature Raman de la matière. Par exemple, si les excipients présentent une fluorescence ou un signal très fort, cela peut masquer le signal du principe actif. Par exemple, l’aspirine et la Juspirine, présentent tous les deux, une concentration similaire en principe actif, mais on voit (Figure 1) que le spectre de l’aspirine est plus intense et mieux résolu – spectres acquis exactement dans les même conditions - que celui-ci de la juspirine. Ceci s’explique par un masquage du signal Raman de l’acide salicylique par les excipients de la formulation du comprimé.
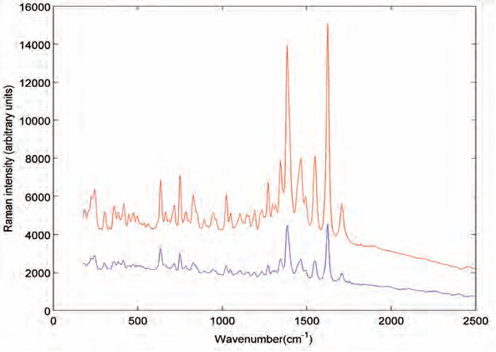 |
| Fig 1 : spectre Raman d’une aspirine (rouge) et de la jusprine (bleu) mesurés avec l’unité Raman portable NanoRam®. |
On peut aussi observer sur le Tableau 1 qu’un des échantillons de Plavix prélevé sur le terrain (référence : T3B2) a été refusé par l’instrument, qui indique une probabilité nulle d’être le bon produit. Ceci correspond sans doute à une contrefaçon de ce médicament. La référence T3B3 a été refusée également par l’unité NanoRam®, avec une faible probabilité d’être le bon produit ; on peut penser qu’il s’agit dans ce cas soit d’une contrefaçon soit d’un lot de faible qualité. Par contre, l’échantillon T3B1 a été reconnu comme le bon produit et la bonne formulation avec une probabilité élevée.
De manière similaire, les analyses, des comprimés de Propranolol ont donné des résultats nets et rapides : T6B1 est reconnu comme un bon produit, alors que T6B2 et T6B3 sont reconnus comme des contrefaçons.
Une étude plus approfondie des données a confirmé par la suite, avec des logiciels d’appui, les données prises sur le terrain. Une étude plus détaillée de ces échantillons est présentée dans la référence [8].
Ces résultats illustrent le potentiel de l’utilisation sur le terrain de la technologie portable Raman. Elle simplifie de façon considérable la tâche de surveillance des compagnies, des inspecteurs des organismes gouvernementaux et des forces de sécurité pour la surveillance des produits médicaux présents sur un marché ou sur le point d’y entrer. Des informations fiables peuvent etre obtenues sans avoir le besoin de diriger tous les échantillons à des laboratoires de contrôle.
 |
| Fig. 2: Nanoram® en utilisation pour la caractérisation directe d’une matière à travers son emballage. |
4. Conclusion
La spectroscopie Raman a suivi une évolution significative depuis la découverte du phénomène qu’elle exploite.
Dès le début, des avantages indéniables ont été mis en évidence : l’identification, la caractérisation et l’analyse des matériaux réalisées sans contact et sans préparation de l’échantillon.
Les évolutions technologiques récentes l’ont rendue compacte, robuste, polyvalente et accessible à tous.
L’utilisation des nouveaux équipements portables miniaturisés, permettant d’intervenir sur le terrain et capables de fournir très rapidement des informations de bonne fiabilité, est en train de devenir incontournable dans la sécurisation des chaines d’approvisionnement pharmaceutique, pour la détection des produits de mauvaises qualités et pour l’identification des contrefaçons. Dans le domaine de la sécurité, des unités sont déjà déployées pour la détection de drogues ou d'explosifs directement sur terrain.
Le développement de la SERS sera sans doute crucial pour la détection de polluant dans les milieux naturels. Des techniques de modulations spatiales permettrait aussi de pénétrer davantage les matériaux et éviter de se limiter aux mesures surfaciques. Dans le même état d'esprit, des capteurs plus performant permettront de réaliser des mesures Raman en transmission et voir ce qu'il se passe sous la surface d'un comprimé par exemple.
5. Références
[1] G.S. Landsherg, L.I. Mandelstam, "New phenomenon in scattering of light (preliminary report)", Journal of the Russian Physico-Chemical Society, Physics Section 60, 335 (1928).
[2] Jean Cabannes, Rose Aynard. Etude experimentale et theorique sur le spectre Raman de l'eau de cristallisation dans le gypse. J. Phys. Radium, 1942, 3 (8), pp.137-145.
[3] T.H. Maiman: Stimulated Optical Radiation in Ruby. Nature,187, 4736,1960, pp. 493–494.
[4a] T. Hirschfeld and B Chase, ‘FT-Raman Spectroscopy: Development and Justification’, Appl. Spectrosc. 1986, 40, 133-137.
[4b] D.B. Chase, ‘Fourier Transform Raman Spectroscopy’, J. Am. Chem. Soc. 1986, 108, 7485-7488
[5] Mike Hardy, Matthew D. Doherty, Igor Krstev, Konrad Maier, Torgny Möller, Gerhard Müller, and Paul Dawson, Anal. Chem., 2014, 86 (18), pp 9006–9012
[6] A Review of the Theory and Application of Coherent Anti-Stokes Raman Spectroscopy (CARS) Applied Spectroscopy, Vol 31, No 4, July/August 1977, pp. 253-271
[7] K.M. KHAN et al. “Detection of Urea Adulteration in Milk Using Near-Infrared Raman Spectroscopy”, Food Anal. Methods (2015) vol.8, pp. 93-102
[8] Sulaf Assi, European Pharmaceutical Review, Vol 19, 2014 (5), 56-60.
1 Charge Coupled Device
2 Surface Enhanced Raman Scatering
3 Coherent Anti-Stokes Raman Spectroscopy